¿Qué causa el aumento de electronegatividad en los períodos de la tabla periódica?
La electronegatividad es una propiedad química que determina la capacidad de un átomo para atraer electrones hacia sí mismo cuando forma enlace con otro átomo. Es una medida útil para predecir la polaridad de los enlaces químicos y entender cómo se comparten los electrones en una molécula. En este artículo, exploraremos el aumento de la electronegatividad en los períodos de la tabla periódica y las razones detrás de este fenómeno.
¿Qué es la electronegatividad?
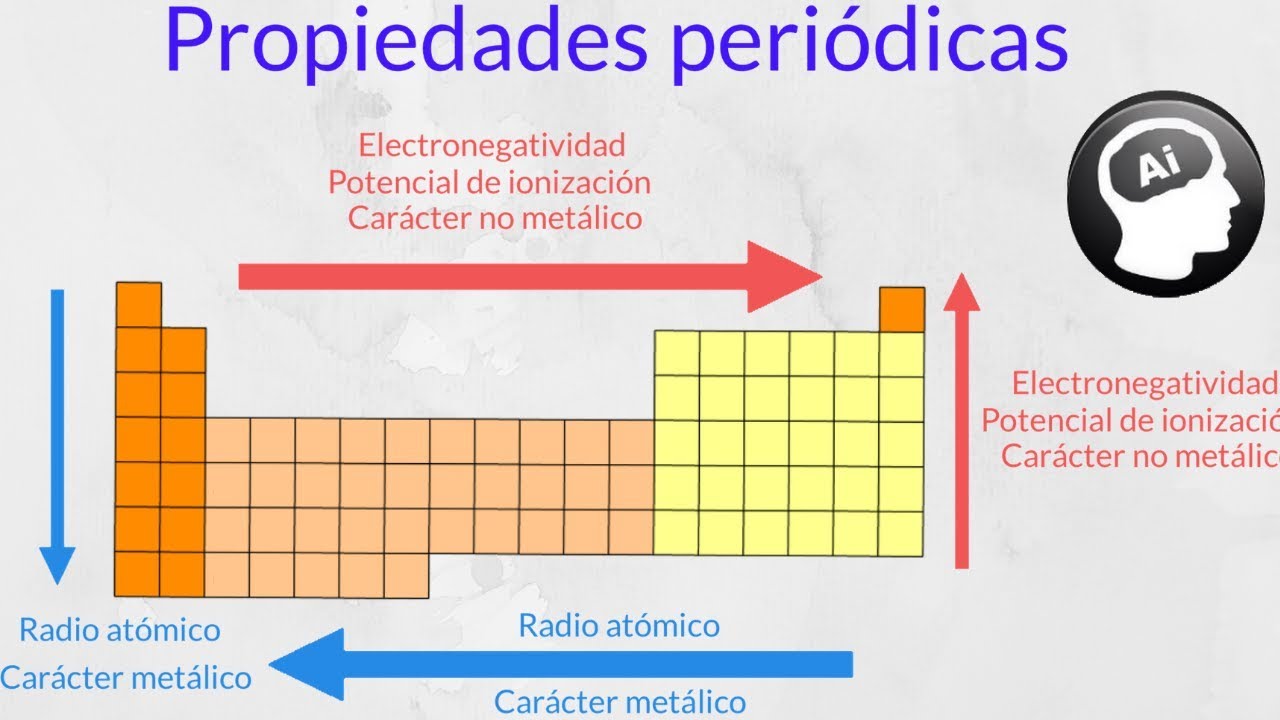
La electronegatividad es una propiedad periódica que varía a lo largo de la tabla periódica. Fue introducida por primera vez por Linus Pauling en 1932 y se mide en una escala arbitraria de 0 a 4. Los elementos más electronegativos se encuentran en la esquina superior derecha de la tabla periódica, como el flúor (F) y el oxígeno (O), mientras que los elementos menos electronegativos se encuentran en la esquina inferior izquierda, como el francio (Fr) y el cesio (Cs).
La electronegatividad de un átomo está determinada por varios factores, incluyendo su número atómico, su carga nuclear efectiva, su tamaño y su estructura electrónica. Cuanto mayor sea la electronegatividad de un átomo, mayor será su atracción por los electrones compartidos en un enlace químico.
Factores que influyen en la electronegatividad
El aumento de la electronegatividad en los períodos de la tabla periódica se debe a varios factores. Uno de los principales factores es el número atómico. A medida que se avanza a lo largo de un periodo, el número atómico aumenta, lo que significa que hay más protones en el núcleo del átomo. Esta mayor carga nuclear efectiva atrae con más fuerza a los electrones, lo que resulta en una mayor electronegatividad.
Otro factor que influye en la electronegatividad es el tamaño del átomo. A medida que se avanza a lo largo de un período, los átomos tienden a hacerse más pequeños debido a un aumento en la carga nuclear efectiva. Los átomos más pequeños tienen una mayor densidad de carga y, por lo tanto, una mayor atracción por los electrones compartidos en un enlace químico. Esto contribuye al aumento de la electronegatividad en los períodos.
Oxígeno y fluoruro como elementos altamente electronegativos
Los elementos oxígeno y flúor son conocidos por tener una alta electronegatividad. El oxígeno tiene un número atómico de 8 y el flúor tiene un número atómico de 9. Esto significa que tienen una mayor carga nuclear efectiva en comparación con otros elementos en el mismo período. Además, ambos elementos son relativamente pequeños en tamaño, lo que aumenta su electronegatividad.
El oxígeno y el flúor forman enlaces altamente polarizados debido a su alta electronegatividad. Esto significa que atraen con fuerza los electrones compartidos en un enlace químico, resultando en una distribución desigual de carga. Por ejemplo, en el agua (H2O), el oxígeno es más electronegativo que el hidrógeno, lo que resulta en una molécula polar en la que el oxígeno tiene una carga parcial negativa y los hidrógenos tienen cargas parciales positivas.
Conclusiones
En resumen, la electronegatividad aumenta en los períodos de la tabla periódica debido a factores como el número atómico y el tamaño del átomo. Cuanto mayor sea el número atómico y más pequeño sea el tamaño del átomo, mayor será la electronegatividad. Elementos altamente electronegativos como el oxígeno y el flúor atraen con fuerza los electrones compartidos en un enlace químico, lo que resulta en enlaces polarizados y moléculas con una distribución desigual de carga.
Preguntas frecuentes
1. ¿Qué es la electronegatividad?
La electronegatividad es una propiedad química que determina la capacidad de un átomo para atraer electrones hacia sí mismo cuando forma enlace con otro átomo. Es una medida útil para predecir la polaridad de los enlaces químicos y entender cómo se comparten los electrones en una molécula.
2. ¿Qué factores influyen en la electronegatividad?
La electronegatividad está influenciada por factores como el número atómico, la carga nuclear efectiva, el tamaño del átomo y la estructura electrónica.
3. ¿Por qué el oxígeno y el flúor son elementos altamente electronegativos?
El oxígeno y el flúor tienen números atómicos relativamente altos y tamaños pequeños, lo que los hace altamente electronegativos.
4. ¿Qué son los enlaces polarizados?
Los enlaces polarizados son enlaces químicos en los que los electrones compartidos son atraídos con mayor fuerza hacia uno de los átomos, lo que resulta en una distribución desigual de carga.