Introducción a las zonas en la tabla periódica
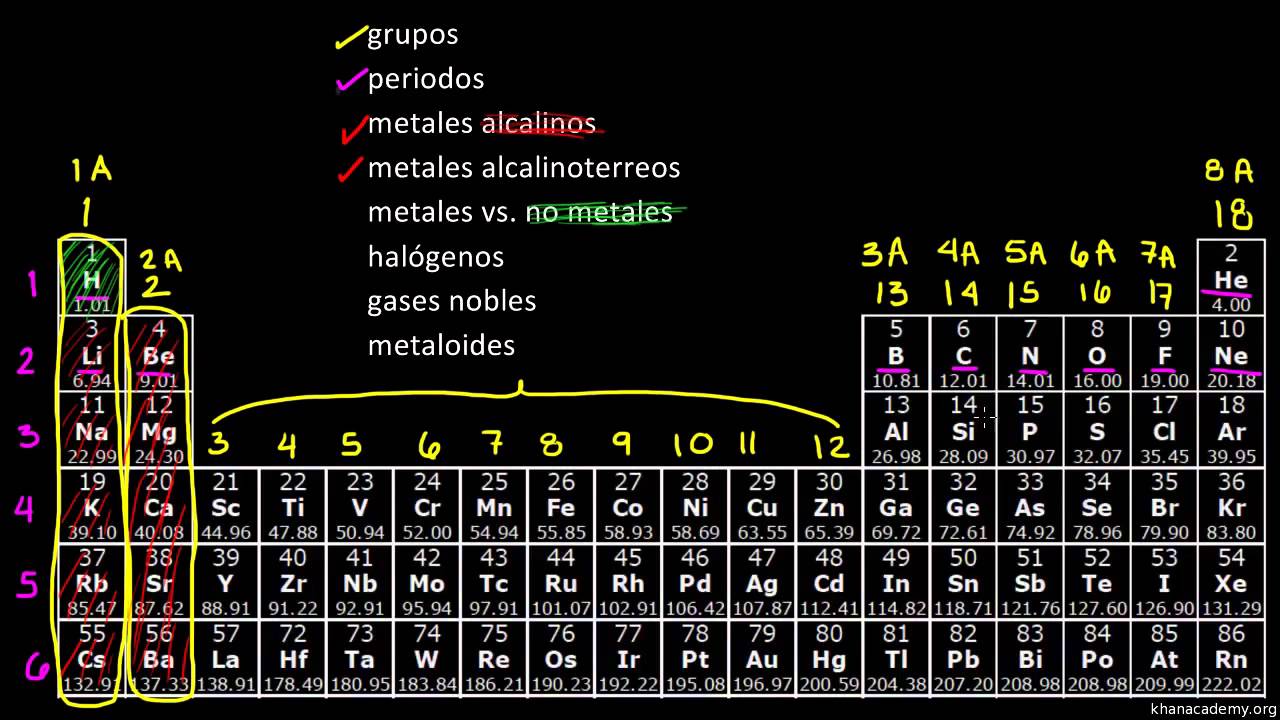
La tabla periódica de los elementos es una herramienta fundamental en la química. Organiza todos los elementos conocidos de acuerdo a su número atómico y configura una estructura que permite identificar patrones y tendencias en las propiedades de los elementos. Dentro de la tabla periódica, es posible identificar diferentes zonas o grupos de elementos que comparten características similares.
Los metales alcalinos:
Los metales alcalinos son un grupo de elementos químicos que se encuentran en el grupo 1 de la tabla periódica. Estos elementos son altamente reactivos y suelen formar compuestos iónicos con facilidad. Algunos ejemplos de metales alcalinos son el sodio, el potasio y el litio.
Los metales alcalinotérreos:
Los metales alcalinotérreos son otro grupo de elementos ubicados en el grupo 2 de la tabla periódica. Aunque también son metálicos, presentan una reactividad menor en comparación con los metales alcalinos. El calcio, el magnesio y el berilio son ejemplos de metales alcalinotérreos.
La zona de transición:
La zona de transición es una región ubicada en el medio de la tabla periódica. Aquí se encuentran los elementos de los grupos 3 a 12. Estos elementos son conocidos por sus propiedades dúctiles y maleables, y muchos de ellos son utilizados en la fabricación de metales.
Los halógenos:
Los halógenos conforman el grupo 17 de la tabla periódica. Son altamente reactivos y suelen formar compuestos iónicos con los metales alcalinos. El cloro, el bromo y el yodo son ejemplos de halógenos.
Los gases nobles:
Los gases nobles son elementos altamente estables y poco reactivos. Se encuentran en el grupo 18 de la tabla periódica y son conocidos por su baja capacidad para formar compuestos. El helio, el neón y el argón son ejemplos de gases nobles.
Conclusiones:
En conclusión, la tabla periódica se encuentra dividida en diferentes zonas o grupos que agrupan a los elementos con características similares. Estas zonas incluyen a los metales alcalinos, los metales alcalinotérreos, la zona de transición, los halógenos y los gases nobles. Conocer y comprender estas zonas nos permite estudiar las propiedades y comportamiento de los elementos químicos de una manera organizada y sistemática.
Zonas principales en la tabla periódica
La tabla periódica se divide en varias zonas principales que representan diferentes categorías de elementos. Estas zonas son importantes para comprender la organización de los elementos y sus propiedades.
1. Metales alcalinos (Grupo 1)
Los metales alcalinos son los elementos que se encuentran en el grupo 1 de la tabla periódica. Estos elementos incluyen el litio, sodio, potasio, entre otros. Son altamente reactivos y se caracterizan por ser metales blandos.
2. Metales alcalinotérreos (Grupo 2)
Los metales alcalinotérreos se ubican en el grupo 2 de la tabla periódica. Ejemplos de estos elementos son el calcio, magnesio y bario. Al igual que los metales alcalinos, son reactivos pero menos que ellos.
3. Metales de transición
Esta zona abarca varios grupos en la tabla periódica, desde el 3 al 12. Los metales de transición son conocidos por su alta conductividad eléctrica y térmica, así como también por su maleabilidad. Ejemplos de estos elementos son el hierro, cobre y zinc.
4. Lantánidos y actínidos
Los lantánidos y actínidos son dos series de elementos que se encuentran en la parte inferior de la tabla periódica. Los lantánidos corresponden a los elementos del 57 al 71, mientras que los actínidos van del 89 al 103. Estos elementos son conocidos por ser radioactivos y utilizados en diversas aplicaciones científicas.
5. No metales
Los no metales son elementos que se encuentran en la parte derecha de la tabla periódica. Ejemplos de no metales son el carbono, oxígeno y nitrógeno. Estos elementos tienden a ser gases o sólidos frágiles y tienen baja conductividad eléctrica y térmica.
6. Gases nobles
Los gases nobles son elementos que se encuentran en el grupo 18 de la tabla periódica. Estos elementos incluyen el helio, neón y argón. Los gases nobles son conocidos por ser muy estables y por su baja reactividad.
La comprensión de estas zonas principales en la tabla periódica es fundamental para entender las tendencias y propiedades de los diferentes elementos.
Características de las zonas en la tabla periódica
La tabla periódica se divide en diferentes zonas que agrupan los elementos según sus características y propiedades químicas. Estas zonas son:
1. Metales alcalinos:
Los metales alcalinos se encuentran en el grupo 1 de la tabla periódica. Son muy reactivos y se oxidan fácilmente en presencia de oxígeno. Son suaves, dúctiles y buenos conductores de electricidad.
2. Metales alcalinotérreos:
Los metales alcalinotérreos se encuentran en el grupo 2 de la tabla periódica. Son menos reactivos que los metales alcalinos, pero aún así se oxidan con facilidad. Tienen una conductividad eléctrica y térmica moderada.
3. Metales de transición:
Los metales de transición se encuentran en los grupos 3 al 12 de la tabla periódica. Son buenos conductores de electricidad y se caracterizan por su alta densidad, punto de fusión y dureza. Muchos de ellos son utilizados en aplicaciones industriales y tecnológicas.
4. Metales de transición interna:
Los metales de transición interna, también conocidos como metales de tierras raras o lantánidos y actínidos, se encuentran en los periodos 6 y 7 de la tabla periódica. Tienen propiedades similares a los metales de transición, pero sus elementos son menos abundantes y más difíciles de obtener.
5. Metaloides:
Los metaloides se encuentran en la zona intermedia entre los metales y los no metales en la tabla periódica. Tienen propiedades tanto de metales como de no metales, y pueden conducir electricidad en determinadas condiciones. Son utilizados en la fabricación de dispositivos electrónicos y semiconductores.
6. No metales:
Los no metales se encuentran a la derecha de la tabla periódica y son malos conductores de electricidad y calor. Algunos no metales son gaseosos (como el oxígeno y el nitrógeno), mientras que otros son sólidos (como el carbono y el azufre).
7. Gases nobles:
Los gases nobles se encuentran en el grupo 18 de la tabla periódica. Son altamente estables y no reactivos debido a que tienen una configuración electrónica completa en su nivel más externo. Se utilizan en diversas aplicaciones como iluminación, refrigeración y medicina.
Estas son solo algunas de las zonas en la tabla periódica y las características principales de cada una. Cada grupo y periodo tiene sus propias peculiaridades, lo que hace de la tabla periódica una herramienta invaluable en el estudio de la química y los elementos químicos.
Importancia de entender las zonas en la tabla periódica
La tabla periódica es una herramienta fundamental en la química, ya que es una representación gráfica de todos los elementos químicos conocidos. Está organizada en filas y columnas, y cada elemento está ubicado en una posición específica.
Para entender mejor la tabla periódica, es crucial comprender las zonas principales en las que se divide:
1. Metales
Los metales son el grupo más grande de elementos en la tabla periódica. Se caracterizan por su brillo, conductividad eléctrica y térmica, y su capacidad de ser maleables y dúctiles. Muchos metales son importantes en aplicaciones industriales y tecnológicas.
2. No metales
Los no metales son elementos que generalmente tienen menor conductividad eléctrica y térmica que los metales. Incluyen gases como el oxígeno y el nitrógeno, así como elementos sólidos como el carbono y el azufre. Los no metales son esenciales para la vida y desempeñan roles importantes en la química orgánica e inorgánica.
3. Metaloides
Los metaloides, también conocidos como semimetales, tienen propiedades intermedias entre los metales y los no metales. Son semiconductores y se utilizan en la industria electrónica, como el silicio en los chips de computadoras.
4. Gases nobles
Los gases nobles son elementos altamente estables y no reactivos. Se encuentran en la columna de la derecha de la tabla periódica y se utilizan en aplicaciones como la iluminación y el enfriamiento.
Al comprender las diferentes zonas en la tabla periódica, podemos obtener información sobre las propiedades y características de los elementos. Esto es crucial para entender cómo interactúan los elementos entre sí y cómo se formulan las sustancias químicas. Además, la tabla periódica nos ayuda a predecir comportamientos químicos y a clasificar los elementos de manera sistemática.
Explorando las diferentes zonas en la tabla periódica
La tabla periódica es una herramienta fundamental en el estudio de la química. A simple vista puede parecer un conjunto de símbolos y números, pero en realidad es mucho más que eso. Cada uno de los elementos químicos que conforman la tabla periódica se encuentra distribuido de manera organizada y sistemática.
1. Zona de los metales
Los metales predominan en la tabla periódica y se encuentran en la parte izquierda de la misma. Son buenos conductores de electricidad y calor, además de ser maleables y tener un brillo característico. Algunos de los elementos más comunes en esta zona son el hierro, el cobre y el oro.
2. Zona de los no metales
Los no metales se ubican en la parte derecha de la tabla periódica. A diferencia de los metales, son malos conductores de electricidad y calor. Algunos ejemplos de no metales son el oxígeno, el nitrógeno y el carbono. Estos elementos son fundamentales para la vida, ya que forman parte de los compuestos orgánicos.
3. Zona de los metaloides
Los metaloides se sitúan en una franja diagonal que separa a los metales de los no metales en la tabla periódica. Estos elementos tienen características intermedias entre los metales y los no metales. Algunos metaloides conocidos son el silicio, el germanio y el arsénico.
4. Zona de transición
La zona de transición se encuentra en el centro de la tabla periódica. Aquí se ubican los elementos de transición, que son caracterizados por tener propiedades metálicas pero también propiedades diferentes a los metales comunes. Estos elementos tienen distintos grupos y periodos, lo que les confiere una gran variedad de propiedades.
5. Zona de tierras raras
Las tierras raras son un grupo de elementos ubicados en la parte inferior de la tabla periódica. A pesar de su nombre, no son realmente tierras ni son raras en abundancia. Sin embargo, son utilizadas en diversas industrias debido a sus propiedades especiales. Algunos ejemplos de tierras raras son el cerio, el europio y el iterbio.
En resumen, la tabla periódica nos permite explorar las diferentes zonas en las que se encuentran distribuidos los elementos químicos. Cada zona tiene sus propias características y propiedades, lo que nos ayuda a comprender mejor la diversidad de la materia.